Strukturālā un molekulārā formula: acetilēns
Acetilēna struktūras īpatnības ietekmē tā īpašības, ražošanu un pielietojumu. Parastā vielas apzīmēšana - C2H2 Vai tā ir vienkāršākā un bruto formula. Acetilēnu veido divi oglekļa atomi, starp kuriem ir trīskāršā saite. Tās klātbūtne atspoguļo dažādus etilēna molekulas formulas un modeļus, kas ļauj izprast struktūras ietekmes uz vielas īpašībām problēmu.
Alkīni. Vispārējā formula. Acetilēns
Alkilūdeņraži vai acetilēns iraciklisks, nepiesātināts. Oglekļa atomu ķēde nav slēgta, tajā ir vienkāršas un vairākas saites. Alkīniju sastāvs atspoguļo kopsavilkuma formulu CnH2n - 2. Šīs vielas klātbūtnes molekulās irviena vai vairākas trīskāršās saites. Acetilēna savienojumi attiecas uz nepiesātinātiem savienojumiem. Tas nozīmē, ka ūdeņraža dēļ rodas tikai viena oglekļa valence. Pārējās trīs saites tiek izmantotas, mijiedarbojoties ar citiem oglekļa atomiem.
Pirmais - un slavenākais pārstāvisalkīni-acetilēns vai ēetīns. Vielas triviālais nosaukums nāk no latīņu vārda "acetum" - "etiķis" un grieķu valodā - "hyle" - "koks". Homologu sērijas dibinātājs tika atklāts 1836. gadā ķīmiskajos eksperimentos, vēlāk viela tika sintezēta no ogles un ūdeņraža ar E. Davy un M. Bertlo (1862). Pie normālas temperatūras un normālā atmosfēras spiediena acetilēns ir gāzveida stāvoklī. Tā ir bezkrāsaina gāze bez smaržas, viegli šķīst ūdenī. Etīns ir vieglāk šķīst etanolā un acetonā.

Acetilēna molekulārā formula
Etīns - vienkāršākais tās homologu sērijas loceklis, tā sastāvs un struktūra atspoguļo formulas:
- C2H2 - etāna sastāvu molekulārs reģistrējums, kas dodpriekšstatu par to, ka vielu veido divi oglekļa atomi un vienāds skaits ūdeņraža atomu. Saskaņā ar šo formulu var aprēķināt savienojuma molekulāro un molāro masu. Kungs (no2H2) = 26 a. e. m., M (C2H2) = 26,04 g / mol.
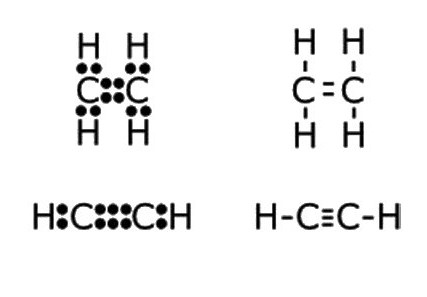
- Н: С ::: С: Н - ацетиленовый электрон-точка формула. Līdzīgi attēli, ko sauc par "Lewis struktūras", atspoguļo molekulas elektronisko struktūru. Rakstot, ir jāievēro noteikumi: ūdeņraža atoms parasti veido hēlija valences apvalka konfigurāciju ķīmiskās saites veidošanā, bet pārējie elementi - ar ārējo elektronu oktetu. Katrs kols nozīmē kopīgu abiem atomiem vai nesaistītu elektronu pāri no ārējā enerģijas līmeņa.
- H-C≡C-H ir acetilēna strukturālā formula, kas atspoguļo saišu secību un daudzumu starp atomi. Viens svītra aizstāj vienu elektronu pāri.

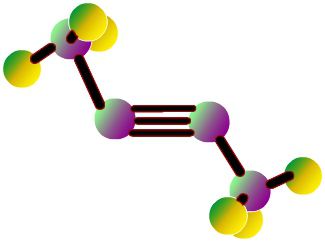
Acetilēna molekulas modeļi
Formulas, kas parāda elektronu sadalījumu,kalpoja par pamatu atomu-orbitālu modeļu, molekulu (stereochemisko) telpisko formulu radīšanai. Jau 18. gadsimta beigās sērijveida stieņu modeļi kļuva plaši izplatīti - piemēram, dažādu krāsu un izmēru bumbiņas, kas apzīmē oglekli un ūdeņradi, veidojot acetilēnu. Molekulas strukturālā formula ir raksturīga stieņiem, kas simbolizē ķīmiskās saites un to skaitu katrā atome.

Atitilēna sfēriskais modelis atveidovalences leņķi ir vienādi ar 180 °, bet starpkadriālie attālumi molekulā ir atspoguļoti aptuveni. Tukšumi starp bumbām nerada priekšstatu par to, ka ir piepildīta atomu telpa ar elektronu blīvumu. Trūkums tiek izslēgts Driding modeļos, kuri apzīmē atomu kodus, kas nav saistīti ar bumbām, bet ar stieņu piestiprināšanas punktiem viens pret otru. Mūsdienu tilpuma modeļi sniedz izteiksmīgāku ideju par atomu un molekulārajiem orbitaliem.
Acetilēna hibrīda atomu orbitāli
Atmosfēras ogleklis satur trīs p-orbitālus un vienu s ar nesaskaņotiem elektroniem. Metāna veidošanās procesā (CH4) viņi piedalās ekvivalenta radīšanāsaites ar ūdeņraža atomiem. Slavenais amerikāņu pētnieks L. Pūlings izstrādāja atomu orbitāļu (AO) hibrīda stāvokļa teoriju. Ķīmisko reakciju oglekļa uzvedības skaidrojums ir AO pielīdzināšana formai un enerģijai, jaunu mākoņu veidošanās. Hibrīdie orbitāli nodrošina stingrākus savienojumus, formula kļūst stabilāka.
Oglekļa atoms acetilēna molekulā, atšķirībā nometāns, veic sp-hibridizāciju. S un p elektroni ir sajaukti pēc formas un enerģijas. Parādās divi sp-orbitāli, kas atrodas 180 ° leņķī, vērsti uz kodola pretējām pusēm.

Trīs savienojums
Acetilēna hibrīda elektroniskajos oglekļa mākoņosiesaistīti veidojot σ obligācijas ar tādiem pašiem kaimiņu atomiem ar ūdeņradi C-H pāriem. Tur paliek divi ne-hibrīdu p-orbitāles, kas perpendikulāri viens otram. Tā molekulā etinilestradiola viņi piedalās veidošanā divu π obligācijas. Kopā ar σ ir trīsvietīga saite, kas atspoguļo strukturālo formulu. Acetilēns atšķiras no etāna un etilēna ar attālumu starp atomiem. Trīskāršā obligācija ir īsāks nekā dubultā, bet ir liels enerģijas rezerve ir spēcīgāka. Maksimālais blīvums σ- un π-saitēm atrodas perpendikulāri jomās, kas noved pie veidošanos cilindriska elektronu mākoni.
Ķīmiskās saites īpatnības acetilēnā
Etilēna molekulai ir lineāra forma, kas ir veiksmīgaatspoguļo acetilēna - H-C≡C-H ķīmisko formulu. Oglekļa un ūdeņraža atomi ir taisni, starp tiem ir 3 σ- un 2 π-saites. Brīvas kustības dēļ rotācija pa asi C-C nav iespējama, to novērš daudzu saišu klātbūtne. Citas trīskāršās saites:
- elektronu pāra skaitlis, kas savieno divus oglekļa atomus, ir 3;
- garums - 0.120 nm;
- Pārrāvuma enerģija ir 836 kJ / mol.
Salīdzinājumam: molekulām etāna un etilēna vienu garuma un divkāršu ķīmiskās saites - 1,54 un 1,34 nm, attiecīgi, enerģija sprauga C-C ir 348 kJ / mol, C = C - 614 kJ / mol.
Acetilēna homologi
Acetilēns ir vienkāršākais alkilīnu pārstāvis, kura molekulām ir arī trīskāršā saite. Propyn CH3С≡СН - acetilēna homologs. Trešā alkīniju pārstāvja formula - butiņ-1-CH3CH2С≡СН. Acetilēns ir triāniskais etāna nosaukums. Uz sistemātisku alkīniju nomenklatūru attiecas IUPAC noteikumi:
- lineārās molekulām norādīts nosaukumu galvenās ķēdes, kas radās no grieķu skaitlis, pie kura ir pievienota Piedēklim -in un atomu skaitu ar trīskāršo saiti, piemēram, etinilgrupu, propinilgrupu, butin-1;
- galvenās atomu ķēdes numerācija sākas molekulas beigās, kas ir vistuvāk trīskāršai saitei;
- sazarotajiem ogļūdeņražiem vispirms seko sānu filiāles nosaukums, kam seko galvenās atomu ķēdes nosaukums ar sufiksu -in.
- Nosaukuma pēdējā daļa - skaitlis, kas norāda uz trīskāršās saites atrašanās vietu molekulā, piemēram, butīns-2.
Alkīnu izomerizācija. Īpašību atkarība no struktūras
Etīnam un propīnam trīskārša izomēra navtie parādās, sākot ar Butinu. Oglekļa skeleta izomēri ir pentīns un šādi homologi. Acetilenisko ogļūdeņražu telpiskā izomerizācija nav izpaudusies attiecībā uz trīskāršu saiti.
Pirmie 4 etanola homologi ir gāzes, kas ūdenī ir ļoti šķīstošas. Acetilēna ogļūdeņraži C5 - C15 - šķidrums. Cietās vielas ir etāna homologi, sākot ar ogļūdeņradi C17. Analizē alkīnu ķīmisko dabubūtiska trīskāršās saites ietekme. Ogļūdeņraži šāda veida ir vairāk aktīvs nekā etilēna, dažādas daļiņas ir pievienotas. Tā balstās uz objektu etinilgrupu plaši izmanto rūpniecībā un tehnoloģiju jomā. Sadedzinot acetilēnam, liela siltuma daudzums, kas tiek izmantota gāzes griešanas un metināšanas metāliem.