Kas ir oglekļa monoksīds? Molekulas struktūra
Oglekļa monoksīds, pazīstams arī kā oglekļa monoksīdsgāze, ir ļoti spēcīgs molekulārais sastāvs, ir ķīmisko īpašību inertums un slikti šķīst ūdenī. Šis savienojums arī ir neticami toksisks, kad tas nonāk elpošanas sistēmā, tas apvienojas ar asiņu hemoglobīnu un pārtrauc pārsūtīt skābekli uz audiem un orgāniem.
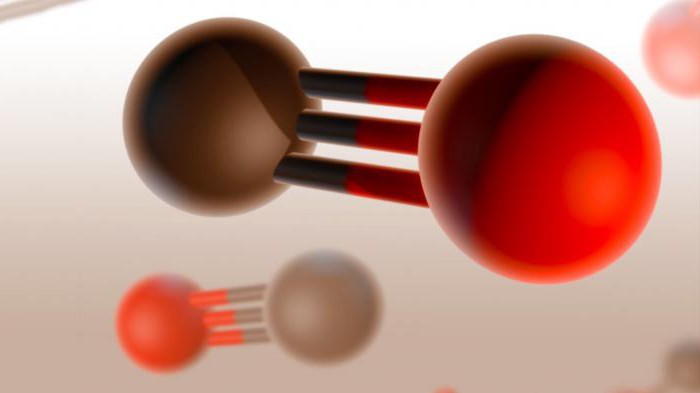
Ķīmiskais nosaukums un formula
Oglekļa monoksīds ir zināms arī saskaņā ar citiemnosaukumi, tostarp oglekļa monoksīds II. Ikdienā to parasti sauc par oglekļa monoksīdu. Šis oglekļa monoksīds ir toksiska, bezkrāsaina un bez garšas gāze, kas ir bez smaržas. Tās ķīmiskā formula ir CO, un vienas molekulas masa ir 28,01 g / mol.

Ietekme uz ķermeni
Oglekļa monoksīds apvienojams ar hemoglobīnu arkarboksihemoglobīna veidošanās, kurai nav skābekļa jaudas. Ieelpojot tvaikus izraisa centrālās nervu sistēmas bojājumu (centrālo nervu sistēmu), un nosmakšanas. Rezultātā skābekļa trūkums izraisa galvassāpes, reibonis, palēnināta sirdsdarbība un elpošanas ātrumu, kā rezultātā bezsamaņa un pēc tam organisma nāvi.

Toksiska gāze
Oglekļa monooksīdu ražo daļējioglekli saturošu vielu, piemēram, iekšdedzes dzinēju, sadedzināšana. Savienojums satur 1 oglekļa atomu, kovalenti saistīts ar 1 skābekļa atomu. Oglekļa monoksīds ir ļoti toksisks, un tas ir viens no visbiežāk sastopamajiem letāla saindēšanās cēloņiem visā pasaulē. Iedarbība var izraisīt sirds un citu orgānu bojājumus.

Kāda ir oglekļa monoksīda izmantošana?
Neskatoties uz nopietno toksicitāti, ir monoksīdsogleklis ir ļoti noderīgs - pateicoties mūsdienu tehnoloģijām, no tā tiek radīti vairāki būtiski produkti. Oglekļa monoksīds gan mūsdienās tiek uzskatīts piesārņotājs vienmēr klāt dabā, bet ne tādā daudzumā, kā, piemēram, oglekļa dioksīdu.
Tie, kas uzskata, ka viņiem nepastāv, ir kļūdainioglekļa monoksīda savienojumi dabā. CO izšķīst izlijušā vulkāniskajā akmenī ar augstu spiedienu Zemes apvalkā. Oglekļa oksīdu saturs vulkāniskajās gāzēs svārstās no mazāk nekā 0,01% līdz 2%, atkarībā no vulkāniem. Tā kā šā savienojuma dabīgums nav nemainīga, nav iespējams precīzi noteikt dabasgāzes emisijas.

Ķīmiskās īpašības
Oglekļa monoksīds (CO formula) attiecas uz ne sāls veidojošiem vai indiferentiem oksīdiem. Tomēr, temperatūrā +200 oC tā reaģē ar nātrija hidroksīdu. Šī ķīmiskā procesa laikā veidojas nātrija formiāts:
NaOH + CO = HCOONa (skudrskābes sāls).
Oglekļa oksīda īpašības ir balstītas uz tā samazināšanas spējām. Oglekļa monoksīds:
- var reaģēt ar skābekli: 2CO + O2 = 2CO2;
- spēj reaģēt ar halogēniem: CO + Cl2 = COCl2 (fosgēns);
- ir unikāls īpašums, lai atgūtu tīru metālu no to oksīdiem: Fe2O3 + 3CO = 2Fe + 3CO2;
- veido karbonilus no metāliem: Fe + 5CO = Fe (CO)5;
- lieliski šķīst hloroformā, etiķskābē, etanolā, amonija hidroksīdā un benzolā.
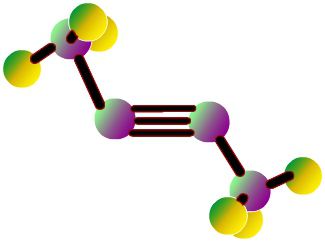
Molekulārā struktūra
Divi atomi, no kuriem faktiski irmolekula no oglekļa monoksīda (CO), kas ir saistīta trīskāršo saiti. Divas no tām tiek veidoti, apvienojot p-elektronus no oglekļa atomiem ar skābekli, un trešais - pateicoties īpašu mehānismu, jo bez oglekļa 2p orbītas un 2P-elektronu pāriem skābekli. Šī struktūra nodrošina molekulu ar augstu izturību.

Nedaudz vēstures
Aprakstīts Aristotelis no senās Grieķijastoksiski izgarojumi, kas rodas, sadedzinot ogles. Patiesais nāves mehānisms nebija zināms. Tomēr viena no senajām izpildes metodēm bija likumpārkāpuma likumu bloķēšana tvaika istabā, kur atrodas ogles. Grieķu ārsts Galens ierosināja, ka gaisā notiek dažas izmaiņas, kas nodara kaitējumu ieelpojot.
Otrā pasaules kara laikā gāzes maisījums aroglekļa monoksīda piemaisījumi tika izmantoti kā degviela transportlīdzekļiem tajās pasaules daļās, kur bija ierobežots daudzums benzīna un dīzeļdegvielas. Ārēji (ar dažiem izņēmumiem) tika uzstādīti kokogļu vai koksnes gāzes ģeneratori, un gāzu maisītājā tika ievadīts atmosfēras slāpekļa, oglekļa monoksīda un nelielu citu gāzu maisījums. Tā bija tā sauktā koksnes gāze.
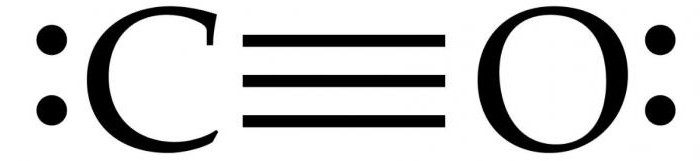
Oglekļa monoksīda oksidēšana
Oglekļa monoksīdu veido oglekli saturošu savienojumu daļēja oksidēšana. CO veido, ja skābeklis nav pietiekams, lai iegūtu oglekļa dioksīdu (CO2), piemēram, kad darbojas krāsns vai dzinējsiekšējā sadedzināšana slēgtā telpā. Ja skābeklis ir klāt, kā arī kādu citu koncentrāciju atmosfērā oglekļa monoksīda apdegumu, izstarojošās zilo gaismu, veidojot oglekļa dioksīdu, kas pazīstams kā oglekļa dioksīds.
Akmeņogļu gāze, ko plaši izmanto līdz pat 60. gadiemPagājušajā gadsimtā iekštelpu apgaismojumam, ēdiena gatavošanai un apkurei CO sastāvā bija degvielas priekšrocības. Daži mūsdienu tehnoloģiju, piemēram, dzelzs kausēšanas procesi, joprojām ražo oglekļa monoksīdu kā blakusproduktu. Ļoti CO savienojums oksidējas CO2 istabas temperatūrā.

Vai ir raksturīgs CO?
Vai ir dabisks oglekļa monoksīds? Viens no tā dabiskajiem avotiem ir trokšņa virsmas fotochemiskās reakcijas. Paredzams, ka šie procesi radīs aptuveni 5 × 1012 kg vielas e; Citi avoti, kā jau minēts iepriekš, ir vulkāni, mežu ugunsgrēki un citi degšanas veidi.
Molekulārās īpašības
Oglekļa monoksīda molārā masa ir 28,0, kas irpadara to nedaudz mazāk blīvu nekā gaiss. Saites ilgums starp diviem atomiem ir 112,8 mikrometri. Tas ir pietiekami tuvu, ka tas nodrošina vienu no visspēcīgākajām ķīmiskajām saitēm. Abiem elementiem CO savienojumā kopā ir aptuveni 10 elektroni vienā valences apvalkā.
Kā likums, organiska karbonilāsavienojumi ir dubultā saite. CO molekulas raksturīga iezīme ir tā, ka starp atomiem ir spēcīga trīskārša saite ar 6 kopīgiem elektroniem 3 saistītajos molekulārajos orbitālos. Tā kā 4 kopējo elektronu izcelsme ir no skābekļa atoma un tikai 2 no oglekļa, tad viena saistītā orbitāla aizņem divi elektroni no O2, veidojot dative vai dipola saiti. Tas izraisa polarizāciju C ← O molekulā ar nelielu "-" oglekļa uzlādi un nelielu skābekļa "+" uzlādi.
Pārējie abi saistītie orbitāli aizņem vienuuzlādēta daļiņa no oglekļa un viena no skābekļa. Molekula ir asimetriska: skābeklis ir lielāks elektronu blīvums nekā ogleklis, un tas ir arī nedaudz pozitīvi uzlādēts, salīdzinot ar negatīvu oglekli.

Saņemšana
Šajā nozarē oglekļa monoksīda CO ražošanu veic, apkuri bez gaisa pieejamības oglekļa dioksīdam vai ūdens tvaikiem ar akmeņoglēm:
CO2 + C = 2CO;
H2O + C = CO + H2.
Pēdējo iegūto maisījumu sauc arī par ūdenivai sintēzes gāze. Laboratorijas apstākļos oglekļa monoksīds II, pakļaujot organiskās skābes koncentrētai sērskābei, kas darbojas kā dehidratējošs līdzeklis:
HCOOH = CO + H2Par;
H2C2Par4 = CO2 + H2O.
Galvenie simptomi un palīdzība ar CO saindēšanos
Vai ir saindēta ar oglekļa monoksīdu? Jā, un ļoti spēcīgs. Saindēšanās ar oglekļa monoksīdu ir visbiežāk sastopamā parādība visā pasaulē. Visbiežāk sastopamie simptomi ir:
- vājuma sajūta;
- slikta dūša;
- reibonis;
- nogurums;
- uzbudināmība;
- slikta apetīte;
- galvassāpes;
- dezorientācija;
- redzes traucējumi;
- vemšana;
- ģībonis;
- krampji.
Var izraisīt šo toksisko gāzu iedarbībuievērojamam bojājumam, kas bieži vien var izraisīt ilgstošus hroniskus patoloģiskus apstākļus. Oglekļa monoksīds var nopietni kaitēt grūtnieces auglim. Nodrošināt tūlītēju palīdzību cietušajiem, piemēram, pēc ugunsgrēka. steidzami jāsazinās ar ātro palīdzību, jānodrošina piekļuve svaigam gaisam, jānoņem elpas apģērbs, mierīgs, silts. Smagu saindēšanos, kā likums, ārstē tikai ārstu uzraudzībā, slimnīcā.
Pieteikums
Kā jau minēts, oglekļa monoksīds ir toksisks unTas ir bīstami, tomēr tas ir viens no pamata savienojumiem, ko modernā rūpniecībā izmanto organiskās sintēzei. CO tiek izmantots, lai ražotu tīru metālu, karbonili, fosgēns, oglekļa sulfīds, metilspirts, formamīdu, aromātiskās aldehīdus, skudrskābe. Šo vielu izmanto arī kā degvielu. Neskatoties uz toksicitāti un toksicitāti, to bieži izmanto kā izejvielu dažādu ķīmisko vielu iegūšanai ķīmiskajā rūpniecībā.
Oglekļa monoksīds un oglekļa dioksīds: kāda ir atšķirība?
Monoksīds un oglekļa dioksīds (CO un CO2) bieži vien ir savstarpēji kļūdaini. Abas gāzes ir bezkrāsainas un bezkrāsainas, un abas tās negatīvi ietekmē sirds un asinsvadu sistēmu. Abas gāzes var iekļūt ķermenī ieelpojot, ādā un acīs. Šiem savienojumiem, pakļauti dzīvam organismam, ir vairāki bieži sastopami simptomi - galvassāpes, reibonis, krampji un halucinācijas. Lielākajai daļai cilvēku ir grūtības noteikt atšķirību un nesaprot, ka automašīnu izplūdes izstaro gan CO, gan CO2 . Telpās, šo gāzu koncentrācijas pieaugums var būt bīstams cilvēka pakļautajai veselībai un drošībai. Kāda ir atšķirība?
Augstās koncentrācijās abi var būt letāli. Atšķirība ir tā, ka CO2 ir vajadzīga kopēja dabasgāzevisa augu un dzīvnieku dzīve. CO nav parasts notikums. Tas ir blakusprodukts, kas saistīts ar anoksiskā kurināmā sadedzināšanu. Kritiskās ķīmiskās atšķirības ir tādas, ka CO2 satur vienu oglekļa atomu un divus skābekļa atomus, bet CO ir tikai viens no tiem. Oglekļa dioksīds ir nedegošs, bet monoksīdam ir liela aizdedzes varbūtība.
Protams, rodas oglekļa dioksīdsatmosfēra: cilvēki un dzīvnieki elpo skābekli un izelpo oglekļa dioksīdu, tas ir, dzīvās būtnes spēj izturēt to nelielā daudzumā. Šī gāze ir nepieciešama arī augiem fotosintēzes veikšanai. Tomēr oglekļa monoksīds dabiski nerodas atmosfērā un var izraisīt veselības problēmas pat zemā koncentrācijā. Abu gāzu blīvums ir arī atšķirīgs. Oglekļa dioksīds ir smagāks un blīvāks nekā gaiss, bet oglekļa monoksīds ir nedaudz vieglāks. Šī funkcija jāņem vērā, uzstādot piemērotus sensorus mājās.