Toluola formula: kas ir toluols un kā to iegūt?
Arēnas, uz kurām attiecas arī toluols, var uzskatīt par priekšteces atvasinājumiem un homologu sērijas pirmo elementu - benzolu. Šīs klases savienojumu vispārīgā formula ir CnH2n-6. Aromātisko ogļūdeņražu molekulas satur benzola gredzenu (gredzenu, kodolu). Toluola formula C7H8 atspoguļo vielas piederību šim lielajamorganisko savienojumu grupa. Daudziem cilvēkiem, toluols ir zināms ar citu nosaukumu - metilbenzols. Vielu plaši izmanto rūpniecībā, izmanto kā organisko šķīdinātāju, traipu tīrīšanas līdzekli un citiem mērķiem.
Kas ir toluols?

Toluola ķīmiskā formula ir C7H8 - var rakstīt citādi: C6H5-CH3. Šajā gadījumā atomu skaits paliek nemainīgs, bet ievērojami atšķiras no benzola, kas ir radikāli - metila.
Izmantojot citus nomenklatūras principus, savienojumu sauc par metilbenzolu un fenilmetānu. Tas pats ir toluols, kura vispārējā formula ir C7H8. Bet pirmajā gadījumā uzsvars tiek likts uz to, kaViens ūdeņraža atoms, kas saistīts ar benzola gredzena oglekli, tiek aizvietots ar metilgrupu. Otrajam nosaukumam izvēlēta cita pieeja. Tiek uzskatīts, ka metānā viens ūdeņradis tiek aizstāts ar fenilgrupu. Šī ir daļiņa, kurā benzols tiek pārvērsts, izdalot ūdeņraža atomu.
Molekulas struktūra
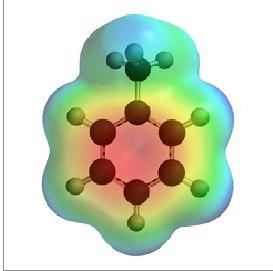
Metilbenzola strukturālās formulas
Elektronu blīvums starp oglekļa atomiem,kas veido aromātisku kodolu, vienmērīgi sadalās. Šī parādība ir atspoguļota benzola, toluola un citu arēnu formā ar aromātisko pazīmju zīmi (aplis gredzenā). Ir arī atzīmēts metil-radikāļa klātbūtne vienā no oglekļa atomiem kodolā. Savienojumi starp visām daļiņām tiek parādīti ar defisēm. Šajā gadījumā strukturālā formula atspoguļo vielas molekulas struktūras sastāvu un galvenās iezīmes.

Vienkāršota toluola formula ir sešstūrains argredzens iekšā vai domuzīmes, kas apzīmē dubultās saites. Metilgrupa var būt jebkurā no sešiem kodolatometiem, un tie ir līdzvērtīgi viens otram. Šīs attēla metodes trūkums ir acīmredzams. Ieraksts nedod priekšstatu par vielas sastāvu un visu oglekļa-oglekļa saišu ekvivalenci gredzenā.

Metilbenzola sagatavošana laboratorijā un rūpniecībā
Laboratorijā toluols pirmo reizi tika iegūts1835-1938 gadi P. Peltier un A. Devil. Pirmais zinātnieks veica desertu no priežu sveķiem un otro lietoto Toluansky balzamu, kas iegūts no Dienvidamerikas Toluifera koka Kolumbijā. Tātad vielas triviāls nosaukums - toluols. Šobrīd ievērojams daudzums metilbenzola iegūst eļļas un akmeņogļu darvas destilāciju, kam seko attīrīšana. Koksēšanas procesā toluolu iegūst no koksa krāsns gāzes. Stienē sintezējot, tas izdalās kā benzola un etilēna reakcijas blakusprodukts. Laboratorijā un rūpniecībā toluola ražošana tiek veikta dažādās metodēs.
- Aciklisko ogļūdeņražu dehidrociklizācija. Toluols tiek gatavots no heptāna katalizatora klātbūtnē 300 ° C temperatūrā.
- Benzola alkilēšana, ko sauca par Friedel-Crafts reakciju. To veic, izmantojot AlCl3 katalizatoru vai citus katalizatorus: C6H5-H + CH3Cl = C6H5-CH3 + HCl.
- Mijiedarbība ar brombenzolu: C6H5-Br + CH3-Br + 2Na = C6H5-CH3 + 2NaBr.
- Cinka un krezola sajaukšana: C6H4CH3OH + Zn = C6H5CH3 + ZnO.
- Toluenesulfonskābes apstrāde.
Metilbenzola fizikālās īpašības

- Dzidrs, bezkrāsains šķidrums izstaro krāsas smaržu.
- Tas cieto metilbenzolu zemās temperatūrās un sāk izkausēt -93 ° C temperatūrā.
- Tluēna viršanas temperatūra ir 110,63 ° C. Vielas blīvums ir 0,8669 g / ml.
- Metilbenzola šķīdība ūdenī 20 ° C temperatūrā ir 0,47 g / l. Vielas mola masa M (C7H8) = 92,14 g / mol.
Toluola ķīmiskās īpašības: oksidēšana
Visu arēnu īpašības tiek noteiktas ķīmiskistabils sešu oglekļa atomu cikls. Toluola formula ir benzola gredzens, kas formāli ir nepiesātināts un metilgrupa. Aromātiskie ogļūdeņraži pēc īpašībām ir līdzīgi alkēniem, kuriem raksturīgas pievienošanās reakcijas. Tomēr, ūdeņraža atomi molekulām no benzola un tā homologiem var piedalīties aizvietošanas reakcijas, kas nes arēnas un alkāniem. Toluols ir vairāk reaktīvs nekā benzols. Vielu raksturo oksidācijas reakcijas.
- Sadedzināšana, ko papildina oglekļa dioksīda izdalīšana un ūdens veidošanās: C7H8 + 9O2 = 7CO2 + 4H2O.
- Toluola reakcijā ar kālija permanganātu metilgrupa vielas molekulas sānu ķēdē oksidējas uz karboksilu. Reakcijas rezultātā iegūst benzoskābi.
Aromātiskā toluola kodola ķīmiskās reakcijas

- Metilbenzola nitrātu veic ar maisījumu,kas sastāv no koncentrētām slāpekļa un sērskābēm. Nitrogrupa toluolā var aizņemt orto- un para-pozīcijas. Reakcija notiek pēc elektrofilās aizstāšanas mehānisma. Pie augstas temperatūras veidojas sprādzienbīstams trinitrotoluols (TNT).
- Hidrogenēšana ar ūdeņradi uz katalizatora izraisa de-aromatizāciju un metilcikloheksāna ražošanu: C7H8 + 3H2 = C7H14.
- Hlorēšana ar spēcīgu uzsildīšanu vai UV starojuma iedarbību tiek pabeigta, veidojot heksahlorcikloheksānu.
Metilbenzola izmantošana
Toluols tiek plaši izmantots kā izejmateriāls organiskās sintēzē. Tas ir būtisks materiāls daudzu vielu ražošanā. Toluola izmantošana:
- krāsu iegūšana;
- traipu noņēmēju, mazgāšanas līdzekļu ražošana;
- TNT sprāgstvielu ražošana;
- izmantot kā adhezīvu, krāsu, sintētisko smaržu un tīrīšanas līdzekļu šķīdinātāju;
- krāsu ražošana būvdarbiem;
- izstrādājumu atlaišana nagiem;
- zāļu ražošana;
- palielināt oktānskaitli;
- organiskās sintēzes benzoskābe, benzaldehyde, benzilgrupa hlorīds, saharīna, benzilspirts un citas vielas;
Toluols darbojas kā rūpniecisksšķīdinātājs ķīmiskajos tīrīšanas līdzekļos, tiek izmantots ādas miecēšanas procesā. Tas ir vairāku naftas produktu, fenola, formaldehīda, pesticīdu un citu savienojumu prekursors.

Toksiskuma toksicitāte
Metilbenzols ir uguns bīstama viela. Tvaika-gaisa maisījums eksplodē noteiktos apstākļos. Tvaika elastīgumu var viegli aizdegties. Strukturālā formula sniedz priekšstatu par sastāvu un struktūru, bet nesatur informāciju par vielas iedarbību uz cilvēka ķermeni. Tika konstatēts, ka toluols ir toksisks, tai ir kancerogēna iedarbība. Metilbenzola pāri brīvi iekļūst caur ādu, elpošanas sistēmu, izraisa izmaiņas centrālajā nervu sistēmā, gremošanas traktu kairinājumu, dermatītu. Inhalējot toluola izgarojumus, cilvēks izpauž kavēšanos, trīce, tiek traucēta vestibulārā aparāta darbība. Darbs ar toluolu, krāsas, šķīdinātājus gumijas cimdos, uzmanīgi ventilējiet telpu vai izmantojiet kapuci. Metilbenzols ir vāja narkotiska viela, kas izraisa toluola toksikomāniju. Citas nelabvēlīgas iedarbības formas:

- acu kairinājums un krāsas redzes traucējumi;
- ilgstoša iedarbība var izraisīt dzirdes zudumu;
- augsta koncentrācija asinīs izraisa aknu bojājumus, nieru nekrozi;
- Liela daudzuma tvaiku ieelpošana izraisa reiboni, miegainību, galvassāpes.
Secinājums
Toluols tiek ražots lielos daudzumosnaftas ķīmijas rūpnīcās vai ko iegūst kā blakusproduktu koksa rūpnīcās. Šis savienojums ir vērtīga izejviela liela mēroga organisko sintēzi, ko izmanto farmācijas nozarē. Methylbenzene ievada daudzu veidu šķīdinātājus, kurus izmanto darbā ar krāsošanas materiāliem. Toulīns pieder toksisko savienojumu klasifikācijai trešās bīstamības klasē. Strādājot ar vielu, tvaika koncentrācija gaisā nedrīkst pārsniegt sanitāros un higiēnas standartus noteiktās vērtības. Neļaujiet tam atklāt ugunsgrēku, dzirksteļošanu, strādājot ar toluolu, tas var izraisīt sprādzienu. Ir arī vides problēmas, kas saistītas ar toluola izplatīšanu atmosfērā:
- degošas eļļas, dažādu veidu degvielas;
- aktīvās vulkānos;
- mežu ugunsgrēkos;
- izmantojot šķīdinātājus un krāsas.
Toluola toksiskām īpašībām, ugunsgrēka un sprādziena draudiem ir nepieciešama akūta šķidruma un tās tvaika apstrāde.