Skābekļa fiziskās īpašības
Ievads
Katru dienu mēs elim nepieciešamo mumsgaiss. Vai jūs kādreiz esat domājuši par to, no kādām vielām gaiss sastāv no? Visvairāk slāpekļa tajā (78%), kam seko skābeklis (21%) un inertas gāzes (1%). Kaut arī skābeklis nav visbūtiskākā gaisa daļa, bet bez tā atmosfēra nebūtu piemērota dzīvībai. Pateicoties tam, dzīvība ir uz Zemes, jo slāpekļa un inertas gāzes kopā un atsevišķi ir kaitīgas cilvēkiem. Apskatīsim skābekļa īpašības.
Skābekļa fiziskās īpašības
Gaisā skābeklis vienkārši nav atšķirīgs, tāpēctāpat kā parastos apstākļos tas ir gāze bez garšas, krāsas un smaržas. Bet skābekli var mākslīgi pārvērst citos agregācijas stāvokļos. Tātad, pie -183oC tas kļūst šķidrs un -219oC cietina. Bet cieto un šķidro skābekli var iegūt tikai cilvēks, bet dabā tas pastāv tikai gāzveida stāvoklī. Šķidrais skābeklis izskatās šādi (foto). Un cietais ir kā ledus.

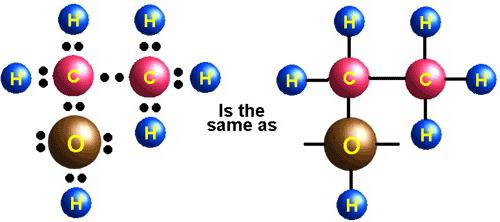
Skābekļa fizikālās īpašības ir arī vienkāršas vielas molekulas struktūra. Skābekļa atomi veido divas šādas vielas: skābekli (O2) un ozons (O.3) Zemāk ir skābekļa molekulas paraugs.

Skābeklis. Ķīmiskās īpašības
Pirmais, ar kuru ķīmiskā viela sākaselementa īpašība ir tā pozīcija DI Menlijejeva periodiskajā sistēmā. Tātad skābeklis ir 6. grupas 2. periodā pie galvenās apakšgrupas 8. punktā. Tās atomu masa ir 16 amu, tas ir nemetāls.
Neorganiskajā ķīmijā tās binārie savienojumi arciti elementi tika apvienoti atsevišķā neorganisko savienojumu klasē - oksīdos. Skābeklis var veidot ķīmiskus savienojumus ar metāliem un nemetāliem.
Parunāsim par tā iegūšanu laboratorijās.
Ar ķīmiskiem līdzekļiem ar skābekli var iegūtizmantojot ūdens elektrolīzi, kālija permanganāta, ūdeņraža peroksīda, bertoleta sāls, aktīvo metālu nitrātu un smago metālu oksīdu sadalīšanās. Apsveriet reakcijas vienādojumus katrai no šīm metodēm.
1. Ūdens elektrolīze:
2H2O = 2H2 + Par2
2. Kālija permanganāta (mangāna) sadalīšanās ar katalizatoru:
KMnO4 = K2MnO4 + KMnO2 + Par2
3. Bertoleta sāls sadalīšanās:
2KClO3 = 2KCl + 3O2
4. Ūdeņraža peroksīda (ūdeņraža peroksīda) sadalīšanās:
H2Par2 = H2O + O2
5. Smago metālu oksīdu (piemēram, dzīvsudraba oksīda) sadalīšanās:
2HgO = 2Hg + O2
6. Aktīvo metālu nitrātu sadalīšanās (piemēram, nātrija nitrāts):
2NaNO3 = 2NaNO2 + O2
Skābekļa pielietojums
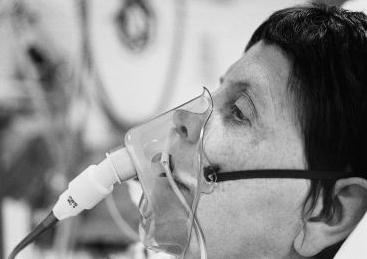
Mēs esam pabeiguši ķīmiskās īpašības. Tagad ir pienācis laiks runāt par skābekļa lietošanu cilvēka dzīvē. Ir nepieciešams sadedzināt degvielu elektriskās un termoelektrostacijās. To izmanto, lai izgatavotu tēraudu no dzelzs un lūžņiem metāla metināšanai un griešanai. Skābeklis ir vajadzīgs ugunsdzēsēju maskām, dažādiem baloniem, ko izmanto melno un krāsaino metālu rūpniecībā un pat sprāgstvielu ražošanā. Arī pārtikas rūpniecībā skābeklis ir pazīstams kā pārtikas piedeva E948. Šķiet, ka nozarē nav vietas, kur to lieto, bet tai ir vissvarīgākā loma medicīnā. Tur viņš sauc - "skābeklis medicīnas". Lai skābeklis būtu piemērots lietošanai, tas ir iepriekš saspiests. Skābekļa fiziskās īpašības veicina to, ka to var saspiest. Šādā veidā tas tiek glabāts iekšā cilindros, kas ir līdzīgi šādam.

To lieto intensīvās terapijas un operācijas laikāiekārtas, kas atbalsta dzīves procesus pacienta organismā, kā arī noteiktu slimību ārstēšanā: dekompresijas, kuņģa un zarnu trakta patoloģijas. Ar viņa palīdzību ārsti katru dienu ietaupa daudz dzīvību. Skābekļa ķīmiskās un fizikālās īpašības veicina to, ka to lieto tik plaši.