Sērūdeņraža ražošana, tās īpašības, pielietojums
Šajā rakstā mēs izskatīsim sērūdeņraža sēra ražošanu. Ļaujiet mums rūpīgāk apskatīt šīs vielas fizikālās un ķīmiskās īpašības.

Struktūra
Lai analizētu galvenosērūdeņraža uztveršanai, ir nepieciešams noskaidrot tās struktūras īpatnības. Šajā vielā ir viens sēra atoms un divi ūdeņradis. Tie ir nemetāli, tādēļ starp elementiem veidojas kovalentas polāras saites. Sērūdeņradī ir leņķiskā struktūra. Starp sēru un ūdeņradi veidojas 92 grādu leņķis, kas ir mazliet mazāks nekā ūdenī.
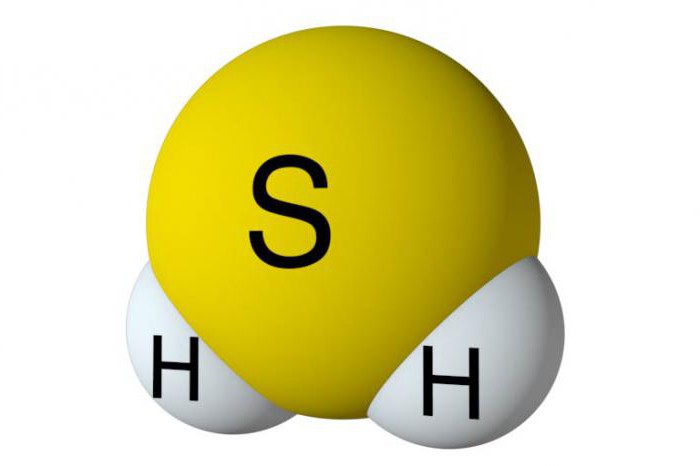
Fizikālās īpašības
Sērūdeņraža smarža, kas atgādina nesadedzinātas olas,visiem pazīstams. Normālos apstākļos šī viela ir gāzveida stāvoklī. Tas nav krāsu, slikti šķīst ūdenī, toksisks. Vidēji ar 20 grādiem pēc Celsija 2.4 tilpumi sērūdeņradis izšķīst ūdenī. Sulfurizētajā ūdenī atklājas nelielas skābes īpašības, vielas disociācija turpinās pakāpeniski. Indīgs sērūdeņradis ir bīstams pat nelielās devās. Gaisā saturošs saturs apmēram 0,1 procentu apmērā no sērūdeņraža izraisa elpošanas centra paralīzi ar samaņas zudumu. Piemēram, leģendārais dabaszinātnieks Plīnijs Vecākais mira 79. gadsimtā pirms mūsu ēras, tas bija sērūdeņradi, kas veidojas izvirduma Vesuvius laikā.
Sērūdeņraža saindēšanās efekta cēlonis ķīmiskajā mijiedarbībā ar asins hemoglobīna līmeni. Šajā proteīnā esošais dzelzs veido sulfīdu ar sērūdeņradi.
Maksimālā pieļaujamā koncentrācija gaisāsērūdeņradis tiek uzskatīts par 0,01 mg / l. Kā pretinde tiek izmantots tīrais skābekļa vai gaisa ieelpojums, kurā ir neliels hlora daudzums.
Darbs ar sērūdeņradi nozīmē atbilstību noteiktiem drošības noteikumiem. Visi eksperimenti, kuros iesaistīta šī gāzveida viela, tiek veiktas noslēgtās ierīcēs un dūmvada pārsegumos.

Sērūdeņraža ražošanas metodes
Kāda ir sērūdeņraža ražošana laboratorijā? Visizplatītākā iespēja ir ūdeņraža un sēra mijiedarbība. Šī ķīmiskā reakcija attiecas uz savienojumu, kas tiek veikts dūmu pārsegumā.
Turklāt sērūdeņraža ražošana ir iespējama arī arapmaiņa starp cieto dzelzs sulfīdu (2) un sērskābes vai sālsskābes šķīdumu. Lai iegūtu šo rezultātu, pietiek ar dažu sulfīda gabalu ņemšanu mēģenē, kas nepārsniedz zirga lielumu. Turklāt mēģenē (līdz pusei tilpuma) pievieno skābes šķīdumu, kas pārklāts ar gāzes izplūdes cauruli. Ierīce tiek novietota zem kapuca, caurule tiek uzkarsēta. Ķīmiskā mijiedarbība ir saistīta ar gāzes burbuļu izdalīšanos. Šāda sērūdeņraža ražošana ļauj radīt daudzumu vielas, kas ir pietiekama, lai ņemtu vērā tā ķīmiskās īpašības.
Kādi citi veidi ir tur? Laboratorija ļauj sērūdeņradi ražot, izmantojot metāliskā dzelzs (zem kapes) mijiedarbību ar kristālisko sēru, pēc tam notiek sulfīda un sērskābes mijiedarbība.

Ķīmiskās īpašības
Ūdeņraža sulfīds mijiedarbojas ar skābekli gaisā,tas sadedzina ar zilganu krāsu. Pilnīgas sadegšanas gadījumā reakcijas produkti ir sēra oksīds (4) un ūdens. Ņemot vērā, ka krāsns gāze ir skābais oksīds, šķīdumā tā veido vāju sērskābi, kas sarkanā krāsā attīra zilo lakmusa papīru.
Nepietiekama sērūdeņraža gadījumā tiek veidots kristālisks sērs. Šo procesu uzskata par rūpniecisku metodi tīra sēra iegūšanai no sērūdeņraža.
Šī ķīmiskā viela ir identificēta unlieliskas atjaunojošas spējas. Tie izpaužas, piemēram, mijiedarbojoties ar sāļiem, halogēniem. Lai veiktu līdzīgu reakciju laboratorijas apstākļos, hlora un broma šķidrumu izšķīdina sērūdeņraža šķīdums, un tiek novērota krāsa. Kā reakcijas produkts tiek novērots kristāliskā sēra veidošanās.
Sērūdeņraža ķīmiskā reakcija ar ūdeni noved pie hidroksonija katijas H3O + veidošanās.
Ūdeņraža sulfīds spēj veidot divu veidu savienojumus: sulfīdus (vidējos sāļus) un hidroksulfīdus (skābes sāļus).
Sārmainā un sārmzemju metālos, sulfīdiir bezkrāsaini savienojumi. Smagajos metos (varš, niķelis, svins) tie ir melni. Mangāna sulfīds ir rozā krāsā. Daudzi sāļi nešķīst ūdenī.
Kvalitatīva reakcija uz sulfīdiem ir mijiedarbība ar vara sulfāta šķīdumu (2). Šīs mijiedarbības produkts ir melnais vara sulfīda nogulsnēšanās (2).
Secinājums
Dabā šī viela ir atrodama minerālvielāsavoti, vulkāniskās gāzes. Šis savienojums ir dzīvnieku un augu organismu sabrukšanas produkts, to raksturo sērūdeņraža raksturīgā smarža. Dabiski sulfīdi sastopami retu metālu sastāvā, metalurģijā iegūstot attiecīgos elementus. Ir arī svarīgi atcerēties, ka sērūdeņradis ir spēcīgs inde.