Elektrolītu īpašības. Spēcīgi un vāji elektrolīti. Elektrolīti - kas tas ir?
Lieliski elektriskās strāvas vadītāji - zelts,varš, dzelzs, alumīnijs, sakausējumi. Līdz ar to pastāv liela nemetālisko vielu grupa, kuru kausējumiem un ūdens šķīdumiem ir arī vadītspēja. Tie ir stipri bāzes, skābes, daži sāļi, kopā ko sauc par "elektrolīti". Kas ir jonu vadītspēja? Ļaujiet mums noskaidrot, kāda saikne ar elektrolītēm ir saistīta ar šo plaši izplatīto fenomenu.

Kādas daļiņas pārvadā izmaksas?
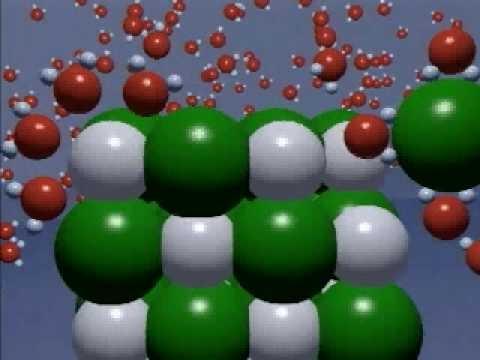
Apkārt pasaulei ir daudz dažādu diriģētāju, kā arīizolatori. Šīs ķermeņa un vielu īpašības ir zināmas kopš seniem laikiem. Grieķu matemātiķis Thaless veica pieredzi ar dzintaru (grieķu valodā - "elektrons"). Zaudēdams to uz zīda, zinātnieks novēroja matu, vilnas šķiedru pievilināšanas fenomenu. Vēlāk kļuva zināms, ka dzintars ir izolators. Šajā vielā nav daļiņu, kas varētu pārvadāt elektrisko lādiņu. Labi vadītāji ir metāli. To sastāvā ir atomi, pozitīvi joni un brīvas, infinitesimālas negatīvās daļiņas - elektroni. Tie nodrošina maksas pārskaitījumu, kad ir pagājis laiks. Spēcīgi elektrolīti sausā veidā nesatur brīvas daļiņas. Bet izšķīdināšanas un kušanas laikā krītošo režģi izzūd, kā arī kovalento saišu polarizācija.
Ūdens, neelektrolīti un elektrolīti. Kas ir šķīdums?
Dodot vai piestiprinot elektronus, atomusmetāla un nemetālisko elementu pārvēršana jonos. Starp tiem kristāla režģī ir samērā spēcīgs savienojums. Jonu savienojumu, piemēram, nātrija hlorīda, izšķīdināšana vai kušana izraisa tā iznīcināšanu. Polāro molekulās nav ne saistītas, ne brīvas jonu, tās rodas, mijiedarbojoties ar ūdeni. XIX gs. 30.gados M. Faraday atklāja, ka dažu vielu šķīdumi darbojas pašreiz. Zinātnieks ieviesa zinātnē šādus svarīgus jēdzienus:
- joni (uzlādētas daļiņas);
- elektrolīti (otra veida vadītāji);
- Katods;
- anoda
Ir savienojumi - spēcīgi elektrolīti, kristāliskā režģa, kas pilnīgi iznīcina ar atbrīvošanu joniem.
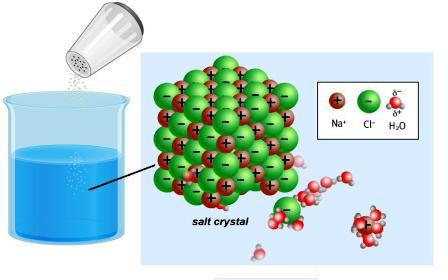
Pastāv nešķīstošas vielas un tāstiek saglabāti molekulārā formā, piemēram, cukurs, formaldehīds. Šādus savienojumus sauc par neelektrolītiem. Viņiem nav raksturīgas uzlādētu daļiņu veidošanās. Vājie elektrolīti (ogles un etiķskābe, amonija hidroksīds un vairākas citas vielas) satur nedaudz jonu.
Elektrolīzes disociācijas teorija
Savos darbos zviedru zinātnieks S. Arrhenius (1859-1927) balstījās uz Faraday secinājumiem. Vēlāk viņa tēzes noteikumus precizēja krievu pētnieki I. Kablukovs un V. Kistjakovska. Viņi uzzināja, ka jonu šķīdināšana un kušanas process veido ne visas vielas, bet tikai elektrolītus. Kas ir S. Arrhenius disociācija? Tas ir molekulu iznīcināšana, kas noved pie lādētu daļiņu parādīšanās šķīdumos un izkausē. S. Arrhenius galvenie teorētiskie noteikumi:
- Pamatnes, skābes un sāļi šķīdumos ir sadalīti.
- Atgriezeniski sadalīt jonās spēcīgi elektrolīti.
- Vāji ioni veido dažus jonus.

Vielas disbociācijas pakāpes indikators (tābieži izteikta kā procentuālā daļa) ir to molekulu skaita attiecība, kas ir sadalījušās jonos, un kopējais daļiņu skaits šķīdumā. Elektrolīti ir spēcīgi, ja šī rādītājs ir lielāks par 30%, vājajiem - mazāk nekā 3%.
Elektrolītu īpašības
S. teorētiskie secinājumi Arrhenius tika papildināts ar vēlākiem krievu zinātnieku veiktiem fizikāli ķīmisko procesu pētījumiem šķīdumos un kūstēs. Izskaidroti bāzu un skābju īpašības. Pirmie ir savienojumi, kuru katijonos esošajos šķīdumos var noteikt tikai metāla jonus, anjoni ir daļiņas OH-. Skābju molekulas sadalās skābes atlikumu negatīvajos jonos un ūdeņraža protonos (H+) Ionu kustība šķīdumā un izkausījumā ir haotiska. Apsveriet eksperimenta rezultātus, kuriem vajadzēs apkopot ķēdi, arī oglekļa elektrodi un parasto kvēlspuldzi. Ļaujiet mums pārbaudīt dažādu vielu šķīdumu vadītspēju: kopējā sāls, etiķskābe un cukurs (pirmie divi ir elektrolīti). Kas ir elektriskā ķēde? Tas ir strāvas avots un vadītāji, kas savienoti kopā. Kad ķēde ir slēgta, sīpola šķīdumā svelme spilgtāka. Jonu kustība iegūst secību. Anjoni tiek novirzīti uz pozitīvo elektrodu un katiņus pret negatīvo elektrodu.
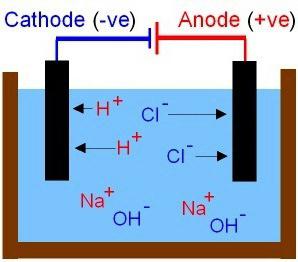
Šajā procesā piedalās etiķskābeneliels daudzums lādētu daļiņu. Cukurs nav elektrolīts, tas nesniedz strāvu. Starp elektrodiem šajā šķīdumā būs izolācijas slānis, spuldze nedeg.
Ķīmiskā mijiedarbība starp elektrolītēm
Kad šķīdumi tiek iztukšoti, var novērot, kā tie novedsevi elektrolītus. Kādi ir līdzīgu reakciju jonu vienādojumi? Apsveriet, piemēram, bārija hlorīda un nātrija nitrāta ķīmisko mijiedarbību:
2NaNO3 + BaCl2 + = 2NaCl + Ba (NO3)2.
Elektrolītu formulas var rakstīt ioniskā formā:
2Na+ + 2NO3- + Ba2+ + 2Cl- = 2Na+ + 2Cl- + Ba2+ + 2NO3-.
Vielas, kas ņemtas par reakciju, ir spēcīgas elektrolītes. Šajā gadījumā jonu sastāvs nemainās. Ķīmiskā mijiedarbība starp elektrolītu šķīdumiem ir iespējama trijos gadījumos:
1. Ja kāds no produktiem ir nešķīstoša viela.
Molekulārais vienādojums: Na2SO4 + BaCl2 = BaSO24 + 2NaCl.
Ļaujiet rakstīt elektrolītu sastāvu jonu formā:
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO24 (baltās nogulsnes) + 2Na+ 2CI-.
2. Viena no veidotajām vielām ir gāze.
3. Starp reakcijas produktiem ir vājš elektrolīts.

Ūdens ir viens no vājākajiem elektrolīta veidiem
Ķīmiski tīrs ūdens (destilēts) nerada elektrisko strāvu. Bet tā sastāvā ir neliels daudzums lādētu daļiņu. Tie ir protoni H+ un anjoni OH-. Nelielais daudzums ūdens molekulu izdalās. Ir vērtība - ūdens jonu produkts, kas nemainīgs 25 ° C temperatūrā. Tas ļauj zināt zūd H koncentrāciju+ un OH-. Skābju šķīdumos pārsvarā ir ūdeņraža joni, sārmās ir lielāki hidroksīda anjoni. Neitrāli - skaitlis H+ un OH-. Šķīduma barotne raksturo ūdeņraža indeksu (pH). Jo augstāks tas ir, jo vairāk ir hidroksīda joni. Medijs ir neitrāls pH diapazonā, kas ir tuvu 6-7. Ar H jonu klātbūtni+ un OH- mainīt krāsu indikatora vielas: lakmusu, fenolftaleīnu, metilorangzi un citus.
Elektrolītu šķīdumu un kūdu īpašībastiek plaši izmantoti rūpniecībā, inženierzinātnēs, lauksaimniecībā un medicīnā. Zinātnisks pamatojums ir noteikts vairāku izcilu zinātnieku darbos, kuri izskaidro daļiņu, kuru sastāvā ir sāļi, skābes un bāzes, uzvedību. Savos risinājumos parādās dažādas jonu apmaiņas reakcijas. Tos izmanto daudzos rūpnieciskos procesos, elektroķīmijā, galvanizācijā. Procesi dzīvās būtnes notiek arī starp joniem šķīdumos. Daudzi nemetāli un metāli, kas ir toksiski atomu un molekulu formā, ir neaizstājami uzlādētu daļiņu veidā (nātrijs, kālijs, magnijs, hlors, fosfors un citi).